生物医药系列:抗癌新希望—癌症疫苗
Time:
2025-04-14
癌症疫苗重塑肿瘤治疗方式。作为兼具预防与治疗双重功能的生物制剂,癌症疫苗通过激活人体免疫系统,识别并清除癌细胞,成为肿瘤领域前沿。英国NHS于2024年启动全球首个千人规模个性化疫苗试验,覆盖结直肠癌、肺癌等六大癌种,旨在为患者量身定制癌症疫苗;Moderna的mRNA-4157联合PD-1抑制剂Keytruda使黑色素瘤患者3年复发风险降低49%。此外,《自然》杂志2025年最新数据显示,9名高风险肾癌患者术后接受个体化疫苗治疗,随访40.2个月均未复发,验证疫苗在根治性治疗中的长期保护潜力。然而,抗原异质性、个体化疫苗高成本以及免疫微环境调控等难题,制约了癌症疫苗大规模应用。本文旨在系统梳理癌症疫苗的概念、原理、技术路线及挑战,并展望未来发展方向,以期增加公众对该领域的认识,促进产业的发展。
一、肿瘤疫苗概念及原理
肿瘤疫苗是通过激活人体免疫系统识别并清除癌细胞的生物制剂。其核心在于利用肿瘤抗原(如基因突变产生的新抗原、病毒相关抗原或肿瘤相关蛋白)训练免疫细胞,实现对癌细胞的精准打击。根据用途可分为预防性疫苗和治疗性疫苗两类:预防性疫苗主要针对致癌病原体,通过阻断感染降低癌症发生率。例如,HPV疫苗使宫颈癌发病率下降90%,EB病毒疫苗可覆盖鼻咽癌、淋巴瘤等10余种癌症;治疗性疫苗则通过靶向肿瘤特异性抗原或肿瘤相关抗原,激活T细胞和抗体攻击已存在的肿瘤,如全球首个获批的Provenge疫苗用于前列腺癌治疗。
癌症疫苗作用原理主要体现在抗原呈递、免疫激活和微环境调控方面。首先,疫苗通过递送肿瘤特异性抗原至抗原呈递细胞(如树突状细胞),后者将抗原片段加工后通过MHC分子呈递给T细胞,激活特异性免疫应答。其次,疫苗佐剂通过增强抗原识别效率,促进T细胞分化为效应细胞和记忆细胞,形成长效免疫记忆。最后,疫苗通过重塑肿瘤微环境打破免疫抑制状态,例如溶瘤病毒T-VEC裂解肿瘤释放抗原并分泌细胞因子,或联合PD-1抑制剂解除免疫检查点抑制,从而逆转低氧、酸性及免疫抑制性细胞(如Treg、MDSC)主导的微环境,将“冷肿瘤”转化为“热肿瘤”,增强免疫细胞浸润和杀伤功能。
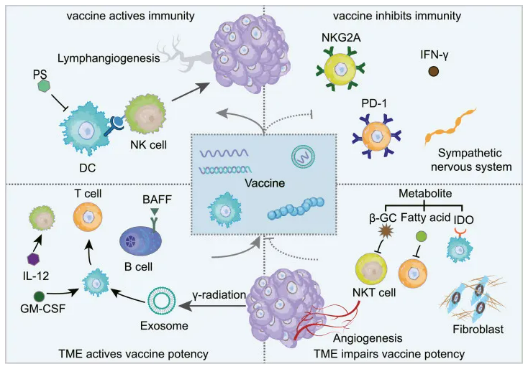
图:肿瘤微环境和癌症疫苗的互作
来源:Zhang SW, Wang H, et al. Bidirectional crosstalk between therapeutic cancer vaccines and the tumor microenvironment: Beyond tumor antigens.
相比于传统疗法,癌症疫苗的优势主要体现在以下方面:一是精准靶向性。肿瘤疫苗通过测序技术识别肿瘤特异性抗原,实现个性化设计,能够精准锁定癌细胞独有的分子标记,避免误伤正常组织,显著优于传统化疗的“无差别攻击”。二是低毒性与安全性。与传统放化疗相比,肿瘤疫苗仅激活针对癌细胞的免疫反应,副作用更小。此外,疫苗不涉及放射性元素或细胞毒性药物,避免了脱发、免疫抑制等传统疗法的常见问题。三是持久免疫记忆与长效保护。疫苗激活的T细胞可形成长期免疫记忆,持续监测并清除残留癌细胞,大幅降低了复发风险。四是联合治疗增效潜力。肿瘤疫苗与免疫检查点抑制剂、化疗等联用可突破免疫抑制微环境,显著提升疗效。
二、技术路线进展
肿瘤疫苗的技术路线呈现多元化发展,不同策略在抗原递送、免疫激活和个性化设计上各具特色。
(一)病毒疫苗
病毒疫苗利用改造后的病毒载体递送肿瘤抗原基因,通过感染宿主细胞触发免疫应答,可分为减毒活病毒载体、灭活病毒和病毒亚单位疫苗等形式。病毒疫苗优势在于高效激活固有免疫并促进抗原交叉提呈,例如,溶瘤病毒T-VEC不仅直接裂解肿瘤细胞释放抗原,还能通过表达粒细胞-巨噬细胞集落刺激因子招募更多免疫细胞。然而,病毒疫苗本身具有免疫原性、会引起宿主对载体本身的免疫,从而影响重复接种的效果。此外该技术面临预存免疫抗体的干扰——部分人群对常见病毒载体存在抗体,可能削弱疫苗效果。临床应用中,T-VEC已在黑色素瘤局部治疗中获批,而基于HPV的病毒疫苗在宫颈癌前病变治疗中也展现出潜力,但其全身性抗肿瘤效果仍需突破。
(二)肽疫苗
肽疫苗通过合成肿瘤特异性抗原的短肽片段,精准激活T细胞应答,具有制备相对简单、特异性高且安全性良好等优点。该类疫苗高度依赖生物信息学预测新抗原表位,并需结合佐剂(如TLR激动剂或纳米载体)增强稳定性与免疫原性。例如,针对端粒酶抗原的UV1长肽疫苗在肺癌中诱导了持续T细胞反应,而个体化新抗原疫苗联合PD-1抑制剂在黑色素瘤中显著降低复发风险。但肽疫苗受限于HLA分型匹配要求,且短肽在体内易被降解,近年来研究者通过设计多表位混合疫苗或融合免疫刺激分子(如CD4+ T细胞表位)来提升覆盖范围与应答强度。
(三)细胞疫苗
细胞疫苗通过改造树突状细胞(DC)或肿瘤细胞实现抗原递呈功能强化。自体DC疫苗如Provenge通过加载前列腺酸性磷酸酶(PAP)抗原,在转移性前列腺癌中延长生存期,但其制备复杂性和成本限制了推广。新兴技术尝试将肿瘤细胞与DC融合,或将CRISPR编辑的肿瘤细胞改造为“疫苗工厂”,使其分泌细胞因子(如IL-12)并表达共刺激分子。尽管这类疫苗能有效激活多克隆T细胞反应,但肿瘤微环境的免疫抑制特性仍是主要障碍,目前多与检查点抑制剂联用以突破微环境限制。
(四)核酸疫苗
以mRNA和DNA为代表的核酸疫苗通过编码肿瘤抗原实现内源性表达,兼具快速开发和强细胞免疫激活的优势。mRNA疫苗借助脂质纳米颗粒(LNP)递送系统,在黑色素瘤、胰腺癌等实体瘤中取得突破——个体化新抗原疫苗联合PD-1抑制剂使术后复发风险显著下降,且生物信息学预测技术的进步提升了新抗原筛选效率。DNA疫苗虽存在转染效率低的问题,但电穿孔技术和启动子优化(如使用CMV增强子)正在改善其效能,针对HPV相关癌前病变的VGX-3100已进入Ⅲ期试验。两类核酸疫苗均面临递送系统升级需求,新型可电离脂质和靶向淋巴结的载体设计成为研发焦点。
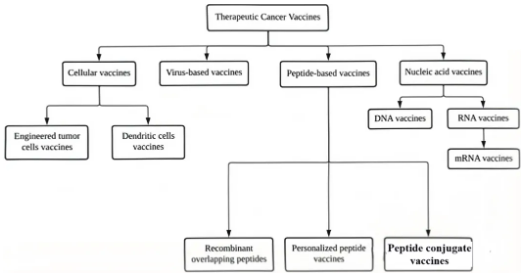
图:癌症疫苗技术路线
三、当前挑战与发展趋势
(一)挑战
癌症疫苗的研发与应用虽取得进展,但仍面临多重科学、技术和临床转化层面的挑战,这些瓶颈制约着其疗效提升与广泛应用:一是肿瘤异质性及抗原筛选难题。肿瘤细胞具有高度异质性,同一患者体内可能存在不同突变谱的亚克隆,导致单一抗原疫苗易引发免疫逃逸。现有生物信息学工具对低频突变或非编码区变异的识别能力有限,且预测的抗原表位仅约20%能在体内真正诱导免疫应答。此外,部分实体瘤(如胰腺癌)突变负荷低,新抗原稀缺,进一步限制了疫苗靶点选择。二是免疫抑制微环境的突破困境。肿瘤微环境中存在调节性T细胞(Treg)、髓源性抑制细胞等免疫抑制细胞,以及TGF-β、IL-10等抑制性细胞因子,形成“冷肿瘤”免疫荒漠。疫苗激活的效应T细胞常因缺乏共刺激信号或遭遇PD-L1等免疫检查点分子而耗竭。三是个体化疫苗的产业化瓶颈。个体化新抗原疫苗需在4-8周内完成从肿瘤采样到疫苗制备的全流程,对测序、算法设计、GMP生产等环节的衔接提出极高要求。目前单例治疗成本高达10万-20万美元,且自动化程度低。四是临床疗效评价体系待完善。传统实体瘤疗效评估标准难以准确反映疫苗诱导的免疫应答效果。部分患者出现“假性进展”,或长期稳定疾病但无客观缓解,现有评价体系低估临床获益。生物标志物方面,除外周血T细胞反应检测外,缺乏可量化肿瘤免疫微环境动态变化的无创监测手段。五是联合治疗策略的优化挑战。尽管疫苗与PD-1抑制剂、化疗等联用已成趋势,但时机选择和剂量优化缺乏共识。此外,放疗或化疗对淋巴细胞数量的影响可能削弱疫苗效果,如何平衡治疗方案仍需探索。
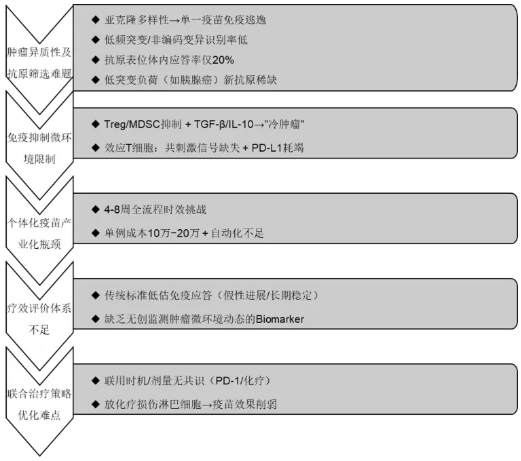
图:癌症疫苗当前面临挑战
(二)发展趋势
1.精准化与智能化抗原设计
新一代疫苗将深度融合多组学技术与人工智能,突破传统抗原筛选瓶颈。通过单细胞测序、空间转录组学解析肿瘤演化,结合深度学习算法预测高免疫原性新抗原,提升表位筛选准确率至50%以上。例如,Neon Therapeutics的算法平台已实现从肿瘤突变到T细胞激活的全程模拟,大幅减少实验验证周期。同时,表位扩展技术(如交叉呈递设计)可覆盖更多HLA亚型,解决患者人群覆盖限制。
2.递送系统的靶向性与多功能化
新型递送载体不再局限于单一抗原运输,而是整合免疫调节功能。脂质纳米颗粒通过引入pH敏感型可电离脂质,实现淋巴结靶向聚集;外泌体载体携带抗原与miRNA抑制剂,同步解除微环境免疫抑制。此外,仿生载体(如红细胞膜包裹纳米粒)可延长循环时间并穿越血脑屏障,为脑瘤疫苗开发铺路。BioNTech的环状RNA技术通过规避天然免疫识别,可实现抗原的持久表达。
3. 联合疗法的机制协同优化
疫苗与免疫检查点抑制剂、溶瘤病毒、代谢调节剂的联用策略将更注重机制协同与时序安排。临床前研究表明,疫苗激活T细胞浸润后,序贯使用PD-1抑制剂可逆转T细胞耗竭;而放疗引发的免疫原性细胞死亡与疫苗联用可产生“原位疫苗接种”效应。针对“冷肿瘤”,STING激动剂与疫苗的局部联用方案(如瘤内注射)已进入Ⅱ期试验,初步数据显示瘤内CD8+ T细胞比例提升3倍以上。
4.个体化向普适化的过渡探索
个体化疫苗的产业化瓶颈催生“半个性化”解决方案。基于共享新抗原库的现成型疫苗可覆盖30%-40%患者群体,缩短制备周期至2周以内。Moderna的mRNA-5671疫苗针对KRAS G12D/G12V等常见突变,正在结直肠癌中开展试验。此外,通用型DC疫苗通过CRISPR编辑过表达CD40L等共刺激分子,可激活多克隆T细胞应答,减少对患者特异性抗原的依赖。
四、总结
癌症疫苗正引领肿瘤治疗迈向精准免疫治疗新时代,其核心价值在于通过激活患者自身免疫系统实现长效抗肿瘤效应。未来,通过技术创新降低制备成本、完善临床疗效评价体系,并深化跨学科合作,癌症疫苗或将成为肿瘤根治性治疗的关键支柱,推动癌症从“不可治愈”向慢性病管理甚至彻底根治的历史性转变。
相关新闻
中关村产业研究院受邀为中关村(海淀)具身智能创新产业园做专题讲座
2021-09-15
2021-09-15
2021-09-15
中关村宜宾正式启航:打造地方科技创新与产业创新融合发展新地标
2021-09-15
